
Menu
Molecular profiling for early patient identification — 1 of 2
Molecular profiling and biomarker-targeted therapy are transforming
patient care in CCA
A genomic analysis revealed that ~50% of patients with CCA had actionable alterations, including FGFR2 fusions or rearrangements13
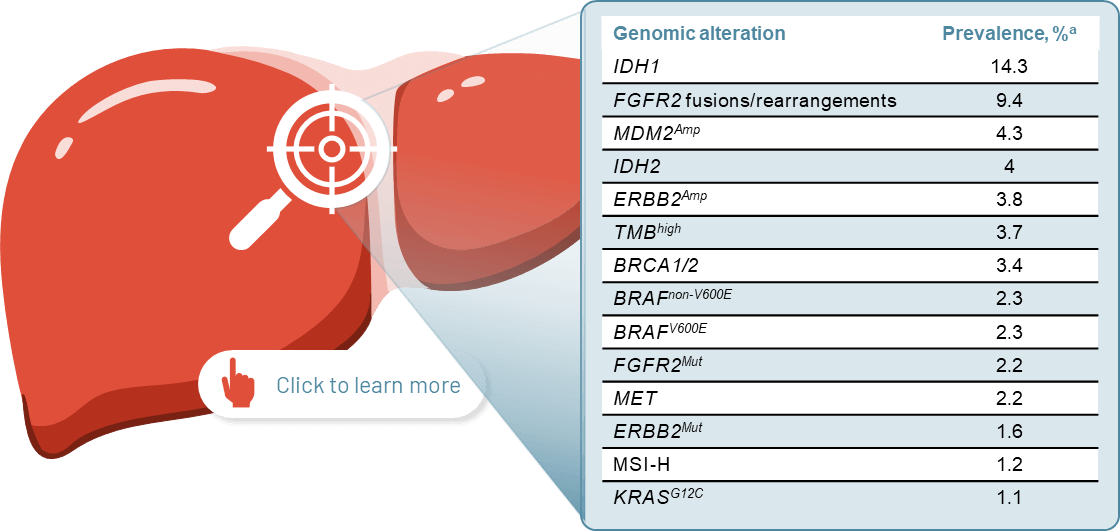
Potentially actionable genomic alterations are abundant in iCCA14a
FGFR2 fusions are detectable early in disease progression and are key drivers of tumour growth. Molecular profiling is necessary to identify FGFR2 fusions or rearrangements15,16
Molecular profiling should be performed before or during 1L therapy using NGS12
Figure adapted from Kendre G, Murugesan K, Brummer T, Segatto O, Saborowski A, Vogel A. Charting co-mutation patterns associated with actionable drivers in intrahepatic cholangiocarcinoma. J Hepatol. 2023 Mar;78(3):614–26.
aBased on a retrospective analysis of 6,130 patients diagnosed with iCCA from the FoundationCORE database who received diagnostic panel sequencing on the FoundationOne platform. Short variants, fusions/rearrangements and copy number alterations in >300 tumour-associated genes were evaluated, and the TMB and MSI status were available for the majority of the cohort.14
IDH1/2 mutations
- Oncogenic conversion of IDH1/2 is caused by single amino acid substitutions at R132 in IDH1, and either R140 or R172
in IDH214 - These mutations decrease enzymatic activity for oxidative decarboxylation of isocitrate to a-ketoglutarate while also inducing the neomorphic NADPH-dependent reduction of
α-ketoglutarate to the D-2-hydroxyglutarate oncometabolite14
FGFR2 fusions/rearrangements and mutations
- Oncogenic conversion of FGFR2 entails ligand-independent catalytic activation through high-level gene amplification, short variants/indels or generation of fusion proteins14
- In iCCA, the most prevalent mechanism of FGFR2 activation is caused by chromosomal rearrangements that, by juxtaposing exons 1–17 of FGFR2 to sequences contributed by a 3’ partner gene, generate hybrid transcripts encoding constitutively dimerised/active fusion proteins14
ERBB2 amplifications and mutations
- ERBB2 (or HER2) is an oncogenic driver and therapeutic target in several solid tumours14
- While copy number alterations dominate the spectrum of oncogenic ERBB2 alterations, biliary tract cancers harbour a significant proportion of ERBB2 short variants14
BRAF mutations (non-V600E and V600E)
- BRAF belongs to the RAF family of mammalian serine/threonine kinases, which transduce signals downstream of RAS via the ERK/MAPK14
BRCA1/2 alterations
- BRCA1/2 are key components of the DNA damage
repair pathway14
KRASG12C mutations
- Mutationally activated RAS family genes act as key oncogenic drivers in solid malignancies14
MET alterations
- Oncogenic activation of the MET tyrosine kinase receptor can be caused by protein overexpression and genomic alterations, such as gene amplification, exon 14 skipping mutations and fusions14
MDM2 amplifications
- TP53 is targeted for proteasomal degradation by the E3 ligase MDM21
- In several cancer entities, MDM2 is upregulated based on gene amplification, increased transcription and/or
enhanced translation14
TMBhigh
- TMB was developed as a surrogate marker for neoantigen load and predictive biomarker of response to immunotherapy with checkpoint inhibitors14
MSI-H
- MSI is a consequence of genomic instability and is
causally linked to deficiencies in the DNA mismatch
repair machinery14

References

- PEMAZYRE® (pemigatinib). Summary of Product Characteristics. September 2023 (data cutoff: 08 July 2021).
- Rizvi S, Borad MJ. The rise of the FGFR inhibitor in advanced biliary cancer: the next cover of Time magazine? J Gastrointest Oncol. 2016 Oct;7(5):789–96.
- Sharma P, Yadav S. Demographics, tumor characteristics, treatment, and survival of patients with Klatskin tumors. Ann Gastroenterol. 2018 Mar-Apr;31(2):231–6.
- Ghouri YA, Mian I, Blechacz B. Cancer review: Cholangiocarcinoma. J Carcinog. 2015 Feb 23;14:1.
- Blechacz B. Cholangiocarcinoma: Current knowledge and new developments. Gut Liver. 2017 Jan 15;11(1):13–26.
- Valle JW, Lamarca A, Goyal L, Barriuso J, Zhu AX. New horizons for precision medicine in biliary tract cancers. Cancer Discov. 2017 Sep;7(9):943–62.
- Bañales JM, Marin JJG, Lamarca A, Rodrigues PM, Khan SA, Roberts LR, et al. Cholangiocarcinoma 2020: The next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol. 2020 Sep;17(9):557–88.
- Bañales JM, Cardinale V, Carpino G, Marzioni M, Andersen JB, Invernizzi P, et al. Expert consensus document: Cholangiocarcinoma: Current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma (ENS-CCA). Nat Rev Gastroenterol Hepatol. 2016 May;13(5):261–80.
- Bertuccio P, Bosetti C, Levi F, Decarli A, Negri E, La Vecchia C. A comparison of trends in mortality from primary liver cancer and intrahepatic cholangiocarcinoma in Europe. Ann Oncol. 2013 Jun;24(6):1667–74.
- Blechacz B, Komuta M, Roskams T, Gores GJ. Clinical diagnosis and staging of cholangiocarcinoma. Nat Rev Gastroenterol Hepatol. 2011 Aug 2;8(9):512–22.
- Forner A, Vidili G, Rengo M, Bujanda L, Ponz-Sarvisé M, Lamarca A. Clinical presentation, diagnosis and staging of cholangiocarcinoma. Liver Int. 2019 May;39 Suppl 1:98–107.
- Vogel A, Bridgewater J, Edeline J, Kelley RK, Klümpen HJ, et al. Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023 Feb;34(2):127–40.
- Lowery MA, Ptashkin R, Jordan E, Berger MF, Zehir A, Capanu M, et al. Comprehensive molecular profiling of intrahepatic and extrahepatic cholangiocarcinomas: potential targets for intervention. Clin Cancer Res. 2018 Sep 1;24(17):4154–61.
- Kendre G, Murugesan K, Brummer T, Segatto O, Saborowski A, Vogel A. Charting co-mutation patterns associated with actionable drivers in intrahepatic cholangiocarcinoma. J Hepatol. 2023 Mar;78(3):614–26.
- Arai Y, Totoki Y, Hosoda F, Shirota T, Hama N, Nakamura H, et al. Fibroblast growth factor receptor 2 tyrosine kinase fusions define a unique molecular subtype of cholangiocarcinoma. Hepatology. 2014 Apr;59(4):1427–34.
- Borad MJ, Gores GJ, Roberts LR. Fibroblast growth factor receptor 2 fusions as a target for treating cholangiocarcinoma. Curr Opin Gastroenterol. 2015 May;31(3):264–8.
- Jain A, Borad MJ, Kelley RK, Wang Y, Abdel-Wahab R, Meric-Bernstam F, et al. Cholangiocarcinoma with FGFR genetic aberrations: a unique clinical phenotype. JCO Precis Oncol. 2018 Nov;2:1–12.
- Silverman IM, Hollebecque A, Friboulet L, Owens S, Newton RC, Zhen H, et al. Clinicogenomic analysis of FGFR2-rearranged cholangiocarcinoma identifies correlates of response and mechanisms of resistance to pemigatinib. Cancer Discov. 2021 Feb;11(2):326–39.
- Barr FG. Fusion genes in solid tumors: the possibilities and the pitfalls. Expert Rev Mol Diagn. 2016 Sep;16(9):921–3.
- Liu PCC, Koblish H, Wu L, Bowman K, Diamond S, DiMatteo D, et al. INCB054828 (pemigatinib), a potent and selective inhibitor of fibroblast growth factor receptors 1, 2, and 3, displays activity against genetically defined tumor models. PLOS ONE. 2020 Apr 21;15(4):e0231877.
- bou-Alfa GK, Sahai V, Hollebecque A, Vaccaro G, Melisi D, Al-Rajabi R, et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol. 2020 May;21(5):671–84 (data cutoff: 22 March 2019).
- Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009 Jan;45(2):228–47.
Abbreviations

Norway API

▼Dette legemidlet er underlagt særlig overvåking
Pemazyre (pemigatinib).
Antineoplastisk middel, proteinkinasehemmer. ATC-nr.: L01E N02. Utleveringsgruppe C. Reseptbelagt legemiddel.
TABLETTER 4,5 mg, 9 mg og 13,5 mg.
Indikasjoner: Monoterapi til behandling av voksne med lokalt avansert eller metastatisk kolangiokarsinom med fibroblastvekstfaktor-reseptor 2 (FGFR2)-fusjon eller -rearrangering, med progresjon etter minst 1 tidligere linje med systemisk behandling.
Dosering: Behandling bør initieres av lege med erfaring i diagnostisering og bruk av kreftlegemidler. Positiv status for FGFR2-fusjon må være kjent før behandlingsstart og svulstprøver bør utføres med passende diagnostisk test. Anbefalt dose er 13,5 mg 1 gang daglig i 14 dager, etterfulgt av 7 dagers behandlingspause. Behandlingsvarighet er inntil sykdomsprogresjon eller uakseptabel toksisitet. Hos alle pasienter bør lavfosfatdiett startes ved serumfosfatnivå >5,5 mg/dl, og tillegg av fosfatreduserende behandling bør vurderes ved nivå >7 mg/dl. Dosen av fosfatreduserende middel bør justeres inntil serumfosfatnivået er <7 mg/dl. Opphold av fosfatreduserende behandling og diett bør vurderes ved behandlingspauser med pemigatinib eller hvis serumfosfatnivået faller under normalområdet. Alvorlig hypofosfatemi kan forekomme sammen med forvirring, anfall, fokale nevrologiske funn, hjertesvikt, respirasjonssvikt, muskelsvakhet, rabdomyolyse og hemolytisk anemi. For dosejustering ved samtidig bruk med sterk CYP3A4-hemmer, se SPC.
Håndtering av toksisitet: Ved toksisitet bør doseendring eller seponering vurderes. Behandlingen bør seponeres permanent hvis pasienten ikke tåler 4,5 mg pemigatinib 1 gang daglig. For anbefalte dosereduksjonsnivåer og doseendring ved hyperfosfatemi og serøs netthinneløsning, se SPC.
Spesielle pasientgrupper: Ved alvorlig nedsatt lever- eller nyrefunksjon bør pemigatinibdosen til pasienter som tar 13,5 mg 1 gang daglig reduseres til 9 mg 1 gang daglig, og dosen til pasienter som tar 9 mg 1 gang daglig reduseres til 4,5 mg 1 gang daglig.
Administrering: Tas til omtrent samme tid hver dag. Kan tas med eller uten mat. Svelges hele.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Samtidig bruk med johannesurt (prikkperikum).
Forsiktighetsregler: Hyperfosfatemi: Forventes. Behandlingsanbefaling ved hyperfosfatemi omfatter fosfatbegrensende diett, fosfatreduserende preparat og doseendring når nødvendig. Hypofosfatemi: Opphold av fosfatreduserende behandling og diett bør vurderes under behandlingspauser med pemigatinib eller hvis serumfosfatnivået faller under normalområdet. Alvorlig hypofosfatemi kan forekomme sammen med forvirring, anfall, fokale nevrologiske funn, hjertesvikt, respirasjonssvikt, muskelsvakhet, rabdomyolyse og hemolytisk anemi. Ved hyper- eller hypofosfatemi, anbefales ekstra nøye overvåkning og oppfølging mtp. dysregulering av benmineralisering. Serøs netthinneløsning: Pemigatinib kan gi serøs netthinneløsning, som kan gi symptomer som tåkesyn, flytere i synsfeltet eller fotopsi. Oftalmologisk undersøkelse, inkl. optisk koherenstomografi (OCT), bør utføres før behandlingsstart og hver 2. måned de første 6 behandlingsmånedene, deretter hver 3. måned, og umiddelbart ved synssymptomer. Ved serøs netthinneløsning bør retningslinjene for dosejustering følges. Forsiktighet bør utvises ved behandling ved klinisk signifikant medisinsk øyetilstand, som retinale lidelser, inkl., men ikke begrenset til, sentral serøs retinopati, makulær/retinal degenerasjon, diabetisk retinopati og tidligere netthinneløsning. Tørre øyne: Pemigatinib kan gi tørre øyne. Lindrende øyepreparater bør brukes for å forebygge/behandle tørre øyne, alt etter behov. Fostertoksisitet: Kan gi fosterskader. Gravide bør informeres om mulig risiko. Økt blodkreatinin: Pemigatinib kan øke serumkreatinin ved å redusere renal tubulær kreatininsekresjon. CNS-metastase: Doseringsanbefaling kan ikke gis, men det forventes at passeringen av pemigatinib gjennom
blod-hjernebarrieren er lav. Bilkjøring og bruk av maskiner: Pemigatinib har moderat påvirkning på evnen til å kjøre bil og bruke maskiner. Fatigue og synsforstyrrelser kan oppstå. Forsiktighet bør utvises ved bilkjøring eller bruk av maskiner.
Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse på felleskatalogen.no.
Effekter av andre legemidler på pemigatinib: Sterke CYP3A4-hemmere: Kan øke forekomst og alvorlighetsgrad av pemigatinibbivirkninger. Pasienter bør rådes til å unngå å spise grapefrukt eller drikke grapefruktjuice mens de tar pemigatinib. Se Dosering i SPC. CYP3A4-induktorer: Kan redusere effekten av pemigatinib. Samtidig bruk med sterke CYP3A4-induktorer bør unngås. Hvis bruk av andre enzyminduktorer er nødvendig, bør bruken overvåkes nøye. Protonpumpehemmere (PPI): Bruk av PPI bør unngås.
Effekter av pemigatinib på andre legemidler: CYP2B6-substrater: Pemigatinib kan redusere eksponeringen for CYP2B6-substrater. Det anbefales nøye klinisk overvåking når pemigatinib administreres sammen med CYP2B6 substrat med en smal terapeutisk indeks. P-gp-substrater: Pemigatinib hemmer P-gp in vitro, og kan øke eksponeringen og dermed toksisiteten av P-gp-substrater. Pemigatinib skal gis minst 6 timer før/etter P-gp-substrat med lav terapeutisk indeks.
Graviditet, amming og fertilitet: Graviditet: Basert på dyrestudier og pemigatinibs farmakodynamikk, skal preparatet ikke brukes under graviditet, med mindre kvinnens kliniske tilstand krever det. Graviditetstest bør utføres før behandlingsstart for å utelukke graviditet. Fertile kvinner bør rådes til ikke å bli gravide, og menn som behandles bør rådes til ikke å gjøre en kvinne gravid under behandlingen. Fertile kvinner, samt menn med fertil kvinnelig partner, bør bruke sikker prevensjon under og i 1 uke etter avsluttet behandling. Barrieremetoder bør brukes som sekundær prevensjon for å unngå graviditet. Amming: Risiko for barnet som ammes kan ikke utelukkes. Amming bør avbrytes under behandling og i 1 uke etter siste dose. Fertilitet: Nedsatt fertilitet hos menn og kvinner kan ikke utelukkes.
Bivirkninger: Svært vanlige (≥1/10): Gastrointestinale: Diaré, forstoppelse, kvalme, munntørrhet, stomatitt. Generelle: Fatigue. Hud: Alopesi, negletoksisitet, Palmar-plantar erytrodysestesisyndrom, tørr hud. Muskel-skjelettsystemet: Artralgi. Nevrologiske: Smaksforstyrrelser. Stoffskifte/ernæring: Hyperfosfatemi (inkl. økt fosfor i blod), hypofosfatemi (inkl. redusert fosfor i blod), hyponatremi. Undersøkelser: Økt kreatinin i blod. Øye: Tørre øyne Vanlige (≥1/100 til <1/10): Hud: Unormal hårvekst. Øye: Punktkeratitt, serøs netthinneløsning, tåkesyn, trikiasis. Mindre vanlige (≥ 1/1 000 til < 1/100): Kutan kalsinose.
Basert på SPC godkjent av SLV/EMA: 26.07.2023.
Pakninger og priser (pr. 07.03.23): 4,5 mg: 14 stk. (blister) kr. 103000,30. 9 mg: 14 stk. (blister) kr. 103000,30. 13,5 mg: 14 stk. (blister) kr. 103000,30.
Byttbar: Nei.
Refusjon: Blå resept: Nei.
Innehaver av markedsføringstillatelsen: Incyte Biosciences Distribution B.V. Paasheuvelweg 25, 1105 BP Amsterdam, Nederland. Repr.: Incyte Biosciences Nordic AB, Barnhusgatan 3, våning 4, SE-111 23 Stockholm, Sverige. Telefon: 00 47 21 03 44 48. E-post: eumedinfo@incyte.com.
Les felleskatalogtekst eller preparatomtalen (SPC) for mer informasjon, se www.felleskatalogen.no
Sist endret: 04.08.2023.
Resources and support

For further information, please refer to the PEMAZYRE Summary of Product Characteristics.1
To request a meeting either for Incyte to contact you or to schedule a visit from an Incyte representative please click here.
To request further medical information, email us at eumedinfo@incyte.com or contact us at our website: https://www.incyte.com/contact-us/medical-information.
